私たちが普段生活に使う水は、純粋な水分(H2O)のほかに様々な不純物を含んでいます。
その不純物の一種にカルシウム(Ca)やマグネシウム(Mg)などのミネラル分があります。これらはCa2+、Mg2+というイオンの形で完全に水に溶け込んでいるのですが、これが石鹸の働きに大きな影響を与えることがあります。
目次
硬度とは
水の中に含まれるカルシウムイオンとマグネシウムイオン(硬度成分)の量を計り、それを元に算出した数値を「硬度」と言います。よく使われるのはアメリカ硬度とドイツ硬度の2種類です。
アメリカ硬度
水1L中に含まれるカルシウムとマグネシウムの量を、炭酸カルシウム(CaCO3)の濃度に置き換えた重量(mg:ミリグラム)で表します。単位はppm。
ドイツ硬度
水100ml中のカルシウムとマグネシウムの量を酸化カルシウム(CaO)の重量(mg)に換算したもので、dHという単位で表します。ちなみにドイツ硬度とアメリカ硬度との関係は「1dH=17.8ppm」となります。
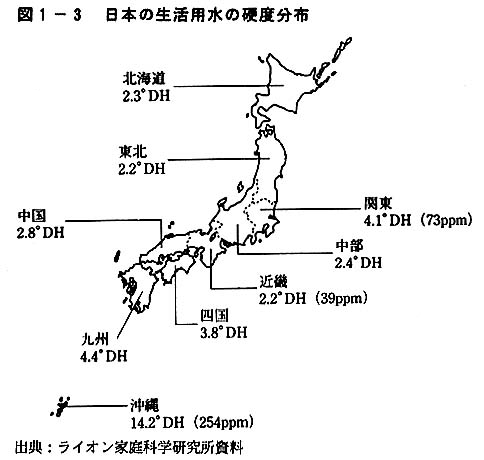
硬水と軟水
硬度値が低い水を軟水、高い水を硬水と呼びます(下記の表参照)。
日本では、生活用水の80%が硬度80ppm以下の軟水に分類されます。これは世界的に見ると大変珍しいことで、アメリカやヨーロッパなどは硬度180ppm以上の硬水地域のほうが軟水地域を遙かに上回っています。
ただし日本でも、温泉地や石灰質の山のそばの地域などは硬度の高い水を生活に使っていることがあります。
参考:中西ら、「被服整理学」朝倉書店 1990
| 硬度 | ppm |
|---|---|
| きわめて軟水 | 0~ 40 |
| 軟水 | 40~80 |
| やや軟水 | 80~120 |
| やや硬水 | 120~180 |
| 硬水 | 180~300 |
| きわめて硬水 | 300以上 |
出典:辻薦著「洗浄と洗剤」
地人書館 1992

金属石鹸
石鹸とカルシウムイオンは、次のように反応して「石鹸」を作ります。マグネシウムも同様です。
| 2RCOONa + Ca2+ | ―→ | (RCOO)2Ca + 2Na+ |
| 石鹸(水に溶ける) | カルシウム石鹸(水に溶けない) |
金属石鹸に洗浄力は無い
カルシウム石鹸やマグネシウム石鹸は「金属石鹸」と呼ばれます。
カルシウムもマグネシウムも金属元素で、それと脂肪酸が結合した金属塩(注1)だからです。石鹸という名前ですが、洗浄力はありません。水に溶けない性質を持ち、一般的には「石鹸かす」とも言われます。
洗い上がった洗濯物に細かい白い粉末が付いていたら、この金属石鹸であることがほとんどです。
注1 塩(えん)とは、酸と塩基が中和反応を起こした結果できる化合物のこと
硬水では金属石鹸ができ易い
硬度の高い水、硬水は硬度成分をたくさん含んでいるので、金属石鹸もたくさんできます。
この反応は石鹸が汚れにとりつくよりも先に起こります。従って金属石鹸が多くできると汚れ落としに回る石鹸分は減ります。
つまり、硬度の高い水は石鹸の効きが悪くなるのです。
ですから同じ程度の汚れ物でも、硬度の高い水で洗うと、硬度の低い水で洗うときよりたくさんの石鹸が必要になります。
硬水を軟水にする方法(軟化法)
一時硬度の場合:煮沸
水中の硬度成分(Ca2+、Mg2+)のうち、炭酸水素塩によるものを「一時硬度」と呼びます。
炭酸水素塩は煮沸すると固形物になり沈殿する性質があります。固形物になって沈殿したカルシウムやマグネシウムは硬度成分ではなくなり、その結果水の硬度は下がります。
硬度が下がると、金属石鹸にされてしまう石鹸も減るので、その分効率的に石鹸を働かせることができます。アメリカやヨーロッパの硬度はこちらであることも多く、熱い湯で洗う機能が付いたドラム式洗濯機が欧米で発達してきたのもこれが理由のひとつです。
| Ca(HCO3)2 | ―→ | CaCO3↓ + CO2 + H2O |
| 炭酸水素カルシウム | 炭酸カルシウム |
永久硬度の場合:アルカリ法やイオン交換法など
煮沸によって除去できない塩化物や硫酸塩として含まれる硬度を永久硬度と呼びます。日本の水の硬度成分はこちらであることが多いようです。
永久硬度を下げる軟化法には以下の様な物があります。
- アルカリ法(水酸化ナトリウムまたは炭酸ナトリウムを用いる)
- イオン封鎖法(エデト酸塩などの金属イオン封鎖剤を用いる)
- イオン交換法(イオン交換樹脂を用いる)
- 逆浸透膜を使って硬度成分を濾し取る
- 電気的に硬度成分を取り除く
